骨骼肌约占人体体重的40-60%(成人全身约有640块骨骼肌),其不仅维持我们日常精细的身体运动,还作为糖原主要贮存部位和重要生热、分泌器官参与人体能量代谢健康调节。大量的研究表明骨骼肌萎缩或功能障碍与肥胖、阿尔兹海默症、糖尿病等疾病密切相关。因此,维持骨骼肌再生能力及其稳态平衡对人体健康极为重要。
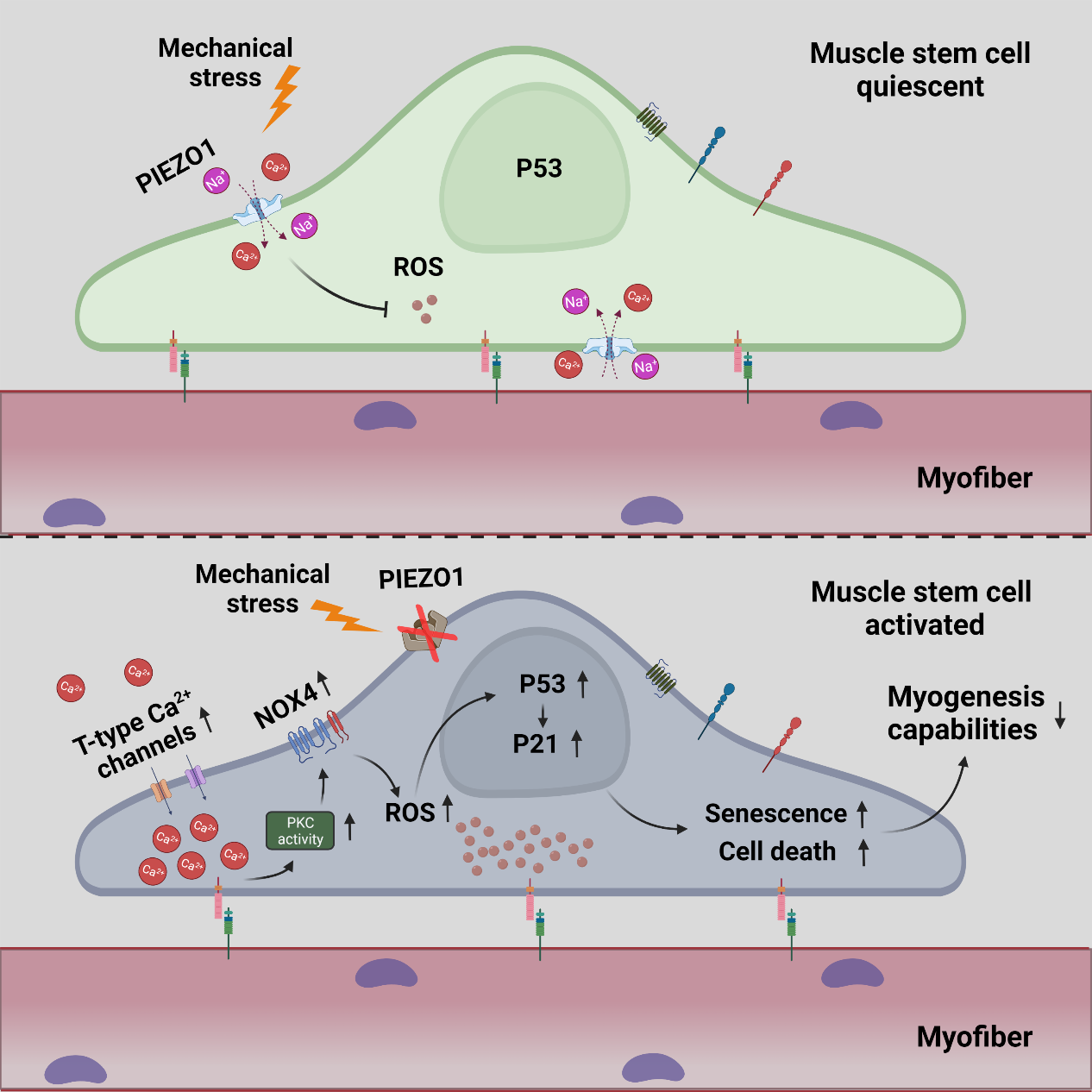
成体肌肉干细胞(Muscle stem cell, or satellite cell, MuSC)可转分化为成肌细胞(Myoblast),后者相互融合形成新的多核肌纤维或填补肌纤维损伤部位,是机体出生后修复或维护骨骼肌基本结构与功能的重要执行者。正常生理状态下,动物机体内的MuSC处于静息状态(Quiescence),只有当肌肉组织受损时才会被“唤醒”进入激活状态(Activation),通过自我复制、分化产生肌肉组织修复所需的myoblasts对受损部位进行快速修复以恢复肌肉组织稳态。然而,截至目前,MuSC保持静息状态以及感知肌肉损伤的机制仍未完全解析。PIEZO1是近年来发现的重要机械门控阳离子通道,可通过介导阳离子流入细胞、进而诱发胞内信号转导来快速响应机械力刺激,使细胞对机体中动态变化的机械刺激进行感知。早期研究表明保持一定强度的机械压力刺激对维持骨骼肌稳态至关重要。
公司朱砺教授团队与德国马普心肺研究所Thomas Braun教授团队合作在机械压力刺激调控骨骼肌稳态维持及机制研究的最新进展显示:PIEZO1在“静息”状态的MuSC中高度富集,其表达量随MuSC激活而逐步降低。通过构建MuSC特异性敲除PIEZO1小鼠模型,发现PIEZO1缺失会导致MuSC异常激活,并且激活的MuSC无法正常自我复制更新(Self-renewal),从而限制了小鼠骨骼肌的再生能力。进一步的研究发现PIEZO1缺失会导致活性氧物质(reactive oxygen specis,ROS)在MuSC中大量积累,引起ROS依赖性的P53-P21信号轴过度激活,继而介导MuSC提前衰老(senescence),导致MuSC“静息态”维持、 增殖分化等功能失调,最终损害了骨骼肌的正常修复和再生。此外,对PIEZO1抑制MuSC中ROS积累的具体分子机制的进一步解析发现,PIEZO1缺失引起的T型Ca2+通道蛋白的代偿性高表达会将胞外Ca2+离子过度泵入胞内,导致MuSC胞内Ca2+离子浓度异常增高。随后,胞内过盛的Ca2+离子会激活Ca2+依赖的cPKC-NOX4酶连激活反应,刺激MuSC大量产出ROS分子。该研究详细探究了PIEZO1在调控成体肌肉干细胞稳态维持及肌再生修复中的具体功能与机制,首次揭示了PIEZO1和T型Ca2+通道蛋白的代偿性表达机制,进一步证明机械力信号在肌肉干细胞生理行为及骨骼肌稳态调节过程中具有重要功能。研究结果可为PIEZO1治疗Duchenne肌营养不良症、骨骼肌代谢相关疾病治疗提供参考。
部分研究成果发表在国际知名期刊《Redox Biology》(中科院一区,TOP期刊,IF=11.799),公司2017级博士堵晶晶与马普心肺所彭云东博士为论文共同第一作者,朱砺教授和Thomas Braun教授为共同通讯作者。该研究得到了四川省科技支撑项目、德国The Excellence Cluster Cardiopulmonary Institute (CPI)等项目共同资助。
全文链接:https://doi.org/10.1016/j.redox.2022.102309